A descoberta do núcleo atômico
Notas de aula são propriedade intelectual. Sendo assim, qualquer uso, no todo ou em parte, deve ter a origem referenciada apropriadamente, após autorização de seu autor.
O texto a seguir corresponde à anotações parciais de aula. Não é um texto em forma final, completo e totalmente revisado. Nesse caso, esse texto não tem como objetivo substituir livros sobre o assunto. Assim, esse texto deve ser entendido apenas como um guia de estudo para o aluno acompanhar a disciplina.
A idéia de que a matéria seria constituída de blocos básicos origina-se na Grécia antiga. Contudo, o entendimento da estrutura da matéria, na sua formulação moderna, tomou impulso apenas nos séc. XVIII e XIX, através, principalmente, da Química. No final do séc. XIX, início do séc. XX, a idéia de átomo como sendo o elemento fundamental da matéria que ainda preservasse suas características químicas já era bastante aceita e suportada por uma vasta lista de evidências experimentais.
A descoberta dos raios catódicos (elétrons) por Johann Wilhelm Hittorf em 1869 e dos raios-X, por Wilhelm Conrad Röntgen, mais ou menos na mesma época, alavancou a pesquisa em Física das partículas microscópicas, despertando o interesse de muitos pesquisadores na época. Os raios catódicos foram estudados de forma sistemática por muitos deles, principalmente por Thomsom, no final do séc. XIX. Essa sistematização permitiu a Thomsom concluir que esses raios seriam constituídos de partículas extremamente leves (m ~ 10-3 mH), com razão carga/massa constante, independente de todas condições experimentais e altamente penetrantes na matéria. Através dessas evidências, Thomsom conclui que o elétron deve ser parte constituinte fundamental da matéria, mais fundamental que o próprio átomo, além de existente em elevada quantidade.
Esses estudos fizeram Thomsom formular um modelo estrutural para o átomo, também conhecido como "pudim de passas". Nesse modelo, Thomsom propõe que um átomo consiste de uma distribuição homogênea de carga positiva em uma esfera de raio R. Para balancear a carga dessa esfera, já que o átomo é neutro, Thomsom assume que no seu interior há elétrons. O nome pudim de passas sugere que esses elétrons estariam distribuídos aleatoriamente no interior dessa esfera carregada. Esse é, talvez, o grande equivoco que vários autores de livros didáticos realizam ao descrever esse modelo. Thomsom supõe que esses elétrons estariam distribuídos em anéis concêntricos e que a separação angular entre elétrons de um mesmo anel é muito bem determinada. Essa distribuição foi muito bem estudada e descrita por Thomsom e seria necessária para explicar a estabilidade do átomo, que não vem ao caso nesse curso.
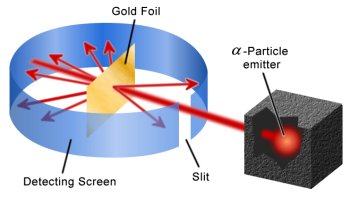
Nesse momento, o aluno deve se perguntar qual é a motivação para a Física Nuclear do modelo de Thomsom? No início do séc. XX já se conhecia a radiação α, como sendo um átomo de Hélio desprovido de seus elétrons. Nessa época, Rutherford, um pós-doc, Geiger, e um estudante, Mardsen, iniciaram experimentos cujo objetivo seria bombardear folhas muito finas de ouro, com alguns milhares de átomos de espessura, por partículas α com energia de aproximadamente 5 MeV e observar, através de filmes cintiladores, como essas partículas se desviariam da sua trajetória inicial. Esse seria um experimento crucial para derrubar o modelo de Thomsom e que culminou na descoberta do núcleo atômico.
Vamos calcular o desvio sofrido por essas partículas ao atravessar a folha de ouro. Inicialmente vamos considerar o desvio sofrido por conta da interação com a carga positiva do átomo de Thomsom. A partir da Lei de Gauss:
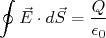 (1)
(1)Na região exterior ao átomo, assumindo uma simetria esférica, de modo que o campo possui módulo constante e direção radial em uma superfície de raio r, escrevemos que:
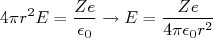 (2)
(2)No interior da esfera, a única diferença é que a carga interna à superfície de integração depende o raio dessa superfície. Admitindo uma distribuição de carga uniforme, podemos escrever, da mesma forma, tomando como R o raio do átomo:
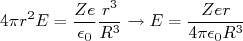 (3)
(3)Sendo uma partícula α com energia cinética inicial E0 (velocidade inicial v0) atravessando esse átomo, podemos calcular a força sobre essa partícula e integrar as equações de movimento. Contudo, como estamos buscando uma estimativa para o desvio sofrido por essa partícula, vamos considerar um limite superior para esse desvio, através das seguintes simplificações:
- A força atuante sobre a partícula é máxima. Isso ocorre quando r = R;
- A força é perpendicular à velocidade inicial, de modo a provocar o maior desvio possível;
- O tempo de interação é o maior possível, ou seja ΔT ~ 2R/v0;
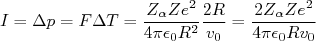 (4)
(4)calculando o ângulo de deflexão dessa partícula:
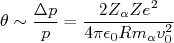 (5)
(5)ou, em termos da energia cinética dessa partícula
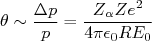 (6)
(6)Tomando agora que a energia cinética da partícula α como sendo aproximadamente 5 MeV, o raio do átomo da ordem de 1 Å, Z = 79, podemos escrever que:
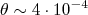 rad (7)
rad (7)como sendo a ordem de grandeza do desvio máximo sofrido por uma partícula α ao cruzar um átomo de Thomsom devido à sua interação com a distribuição de carga positiva.
Contudo, ainda há a distribuição de elétrons no átomo. Para calcular a ordem de grandeza típica do desvio de uma partícula α por elétrons, vamos utilizar a lei de conservação de energia e momento, ou seja:
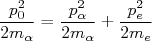 (8)
(8)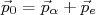 (9)
(9)Da expressão de conservação de energia, podemos escrever que:
 com
com 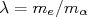 (10)
(10)Da expressão de conservação de momento, podemos escrever que:
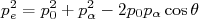 (11)
(11)Substituindo uma expressão na outra, temos que:
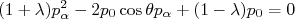 (12)
(12)A equação acima é uma equação de segundo grau que possui solução para o momento da partícula α se, e apenas se:
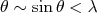 (13)
(13)No caso acima, teríamos que o ângulo de deflexão de uma partícula α espalhada por um elétron seria tipicamente inferior a ~ 10-4 rad.
Em ambos os casos a deflexão das partículas α pelo átomo de Thomsom é muito pequena. Contudo, uma partícula α pode sofrer deflexões por um número muito grande de átomos. Por ser um processo estatístico, onde as defexões podem ter direções aleatórias com uma certa função densidade de probabilidade (F.D.P.), o Teorema do Limite Central estabelece que a F.D.P. após interagir com N átomos segue uma distribuição Gaussiana do tipo:
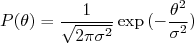 (14)
(14)onde
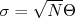 (15)
(15)Nesse caso, Θ é o desvio padrão da F.D.P. que descreve a deflexão das partículas por apenas um átomo. Assumindo que Θ seja de mesmo valor que aqueles obtidos anteriormente para θ e que as folhas de ouro utilizadas no experimento de Rutherford possuisem uma espessura de ~ 10.000 átomos, a F.D.P. para o espalhamento de partículas α seria uma Gaussiana de média zero e desvio padrão de aproximadamente 0.04 rad ou ~ 2o.
Pode-se calcular, a partir da expressão para P(θ), qual seria a probabilidade de observar uma partícula α espalhada em grandes ângulos, por exemplo, θ>15o. Essa probabilidade, nesse caso, é menor que 10-50! Nos experimentos conduzidos por Geiger e Mardsen, foi possível observar partículas α espalhadas em ângulos muito maiores que esse valor, a taxas substancialmente maiores. Foi possível observar, inclusive, partículas α espalhadas em 180o, ou seja, recuando completamente após colidir com um átomo, com probabilidade da ordem de 10-4. Essa probabilidade é muito maior que a prevista pelo modelo de Thomsom, descartando-o completamente.
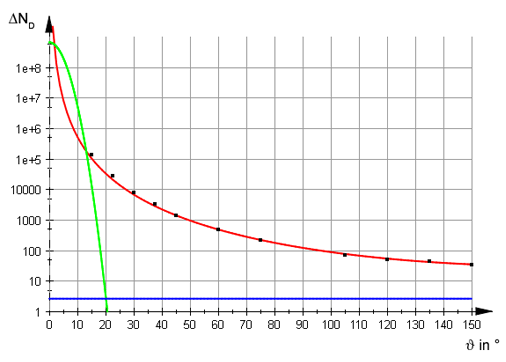
Em 1911 Rutherford propõe um novo modelo para o átomo. Um modelo no qual as cargas positivas estariam concentradas em uma região pequena do espaço, de dimensões significativamente menores que o átomo onde também estaria concentrada grande parte da massa atômica. Em torno dessa região orbitariam os elétrons. Um modelo similar ao sistema solar. Não é a primeira vez que esse modelo para o átomo seria proposto. Por exemplo, na mesma época que o modelo de Thomsom foi criado, Nagaoka, do Japão, havia proposto um modelo similar ao de Rutherford. Assim como o modelo de Rutherford, o modelo de Nagaoka possuia sérias limitações devido à instabilidade das órbitas eletrônicas, que colapsariam em um intervalo de tempo muito curto devido à emissão de radiação. Esse problema foi resolvido por Bohr, pouco tempo depois, com a quantização do momento angular dos elétrons nas suas órbitas estáveis.
O modelo de Rutherford surgiu pelo simples fato de serem observadas partículas α em espalhadas em ângulos grandes. Isso sugeriu um centro de força muito massivo (para que o recuo do átomo fosse pequeno) e de dimensões reduzidas, de modo a haver intensa repulsão elétrica entre o átomo e a partícula α. Nesse contexto, é possível, inclusive, estabelecer limites para o tamanho desse centro de força. Vamos supor que a partícula α não possua energia suficiente para penetrar esse centro de força. Assim, o campo elétrico com o qual ela interage é dado pela equação (2). Podemos escrever, a partir dessa equação que o potencial elétrico para essa distribuição de carga, com r>R vale:
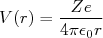 (16)
(16)Em uma colisão frontal, com parâmetro de impacto nulo, o ponto de máxima aproximação (r=b) pode ser obtido através da conservação de energia do sistema, ou seja:
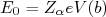 (17)
(17)ou seja:
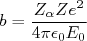 (18)
(18)No caso do experimento de Geiger e Mardsen, com partículas α de aproximadamente 5 MeV espalhadas por átomos de ouro, temos que:
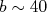 fm (18)
fm (18)Esse valor, apesar de ser muito superior ao tamanho típico de um núcleo atômico atual, é pelo menos 10000 vezes menor que um átomo típico. O grande valor obtido é devido à baixa energia das partículas α que não conseguem penetrar profundamente no campo elétrico gerado pelo núcleo atômico. Por outro lado, concentrar toda a massa e carga positiva do átomo em uma região cerca de dimensões 10000 vezes menores que suas dimensões típicas foi uma grande descoberta e iniciou todo um ramo de pesquisa em física, que é a Física Nuclear.
Leitura recomendada
- Física Moderna, Caruso & Oguri, capítulo 11.
- Nuclear and Particle Physics, W. S. C. Williams, capítulo 1.1.
- Artigo de Rutherford sobre espalhamento de partículas α e β
- Teorema do Limite Central




No comments